








Idiopatická (raná) a sekundární (pozdní) ankylóza zubu v klinické praxi a experimentu
Idiopathic (early) and secondary (late) tooth ankylosis in clinical practice and in experiment









MDDr. Dominika Gedeonová1,2, doc. MUDr. Pavlína Černochová, Ph.D.3,4, prof. MUDr. Lydie Izakovičová Hollá, Ph.D.3,4,
MUDr. Karin Klimo Kaňovská3,4, Mgr. Jana Režnarová, Ph.D.1,2, MUDr. Pavel Hurník5,6, Mgr. Jana Vaculová, Ph.D.5,
doc. RNDr. Marcela Buchtová, Ph.D.7, MUDr. et MUDr. Jan Štembírek, Ph.D.1,2,7
1 Klinika ústní, čelistní a obličejové chirurgie, Fakultní nemocnice Ostrava / Department of Oral and Maxillofacial Surgery, University Hospital Ostrava
2 Katedra kraniofaciálních oborů, Lékařská fakulta, Ostravská univerzita / Department of Craniofacial Surgery, Faculty of Medicine, University of Ostrava
3 Stomatologická klinika, Fakultní nemocnice u sv. Anny, Brno / Department of Stomatology, St.Anne’s University Hospital, Brno
4 Stomatologická klinika, Lékařská fakulta, Masarykova univerzita, Brno / Department of Stomatology, Faculty of Medicine, Masaryk University, Brno
5 Ústav klinické a molekulární patologie a lékařské genetiky, Fakultní nemocnice Ostrava / Department of Clinical and Molecular Pathology and Medical Genetics, University Hospital Ostrava
6 Ústav klinické a molekulární patologie a lékařské genetiky, Lékařská fakulta, Ostravská univerzita / Institute of Molecular and Clinical Pathology and Medical Genetics, Faculty of Medicine, University of Ostrava
7 Laboratoř molekulární morfogeneze, Ústav živočišné fyziologie a genetiky, Akademie věd Brno / Laboratory of Molecular Morphogenesis, Institute of Animal Physiology and Genetics CAS, Brno
Souhrn
Ankylóza stálých zubů je považována za multifaktoriální onemocnění. Mechanismus jejího vzniku na molekulární úrovni zatím není zcela jasný a vzhledem k obtížné diagnostice dosud není známa ani její četnost v populaci.
Ankylózy můžeme rozdělit na idiopatický raný typ, u kterého není jednoznačně známa příčina vzniku a sekundární pozdní ankylózu, kde dominuje posttraumatický stav nebo zánět kolem kořene zubu. Diagnostika je všeobecně založená na anamnéze a klinickém obraze, pro který je charakteristická ztráta mobility ankylotického zubu provázená jasným zvukem při perkusním vyšetření. Ze zobrazovacích metod je možné využít vyšetření pomocí počítačové tomografie (CT), která je ale pro vysokou radiační zátěž nahrazována Cone Beam Computed Tomography (CBCT). V terapii dominuje extrakce ankylotického zubu. Mezi další metody může patřit subluxace zubu s případnou kortikotomií nebo alveolární distrakce v kombinaci s ortodontickou léčbou.
I přes zlepšení zobrazovacích metod, zůstává časná diagnostika zubní ankylózy nadále výzvou a v klinické praxi na ni musí zubní lékař nebo ortodontista v rámci terapeutického plánu myslet.
(Ortodoncie 2023, 32, č. 3, s. 157–170)
Abstract
Permanent tooth ankylosis is a multifactorial condition. Its origin on the molecular level is still rather unclear, and due to difficult diagnosis, the prevalence in the population is not known.
Ankylosis may be classified into idiopathic (early), where the cause is not definitely known, and secondary (late) resulting either from trauma or inflammation around the tooth root. In general, the diagnosis is based on the patient’s history and clinical picture characterized by the loss of the ankylosed tooth mobility accompanied by a distinct sound on percussion. Radiologically, computed tomography (CT) can be used; it is, however, often substituted by Cone Beam Computed Tomography (CBCT) in order to avoid high radiation load. Extraction of the ankylosed tooth is the most common solution. Other methods include tooth subluxation (potentially with corticotomy) or alveolar distraction with orthodontic treatment.
Though more and more advanced imaging methods are used, the early detection of tooth ankylosis is still a challenge and must be considered by dentists and orthodontists when planning therapy.
(Ortodoncie 2023, 32, No. 3, p. 157–170)

Klíčová slova: ankylóza, zub, závěsný aparát zubu, kost, experimentální modely.
Keywords: ankylosis, tooth, anchorage of teeth, bone, experimental models.
Úvod
Kořen zdravého zubu je ke kosti fixován pomocí periodontálních vláken, která tvoří pružný závěs, což umožňuje zubům lépe odolávat žvýkacímu tlaku. Na základě patologického procesu (nejčastěji zánětu nebo traumatu) nebo také bez zřejmé příčiny dochází v periodontální štěrbině ke koagulaci krve, poté k organizaci granulační tkáně, která může postupně osifikovat. Tím dojde k vymizení periodontální štěrbiny a ke spojení povrchu kořene zubu a alveolární kosti, které nazýváme zubní ankylóza [1, 2] (Obr. 1).
Etiologie a výskyt
Ankylóza stálých zubů je považována za multifaktoriální onemocnění; vzhledem k obtížné diagnostice dosud není známa přesná příčina jejího vzniku ani její četnost v populaci.
K ankylotickému procesu dochází desetkrát častěji v dočasné než ve stálé dentici (Obr. 2) a dvakrát častěji v mandibule než maxile, nejčastěji přitom postihuje dočasné druhé dolní moláry. Může se však vyskytnout i ve stálém chrupu, přičemž není významný rozdíl v prevalenci jejího výskytu mezi muži a ženami. Nejčastěji postiženým zubem bývá první stálý molár u dětí a adolescentů [3], což komplikuje ortodontickou léčbu během dospívání. U dospělých je nejčastěji ankylóza přítomna u impaktovaných špičáků [4].
V současnosti jsou ankylózy děleny na idiopatický (raný) typ a sekundární (pozdní) ankylózu. Příčiny vzniku idiopatického raného typu nebyly dosud zcela objasněny. Uvažuje se o kongenitálních vlivech, které se podílejí na formování periodoncia a kosti, tomu by i napovídal zvýšený výskyt zubní ankylózy u pacientů se vzácnou formou CLCN–7 osteopetrózy. Při ní se jedná o poruchu H(+)-ATPasy na membráně osteoklastu, která umožňuje výměnu vodíkových a chloridových iontů přes membránu. I když osteoklasty jsou přítomny v dostatečném počtu, nejsou schopny uvolnit vodíkové ionty, které snižují pH v extracelulárních prostorech a tím pomáhají resorpci kosti [5, 6]. U mutace v tomto genu byly na myším modelu popsány poruchy erupce zubů, dále změny tvaru zubních kořenů, jejich ankylotické spojení s alveolární kostí a velmi málo vyvinutá periodontální ligamenta [7].
Dalším vysvětlením vzniku ankylóz může být tzv. metabolická teorie [3], která předpokládá poškození periodontální buněčné membrány v důsledku narušení lokálních změn v metabolismu buněk. Periodontální vlákna jsou postupně resorbována a nahrazena kostní tkání [8]. Existuje několik klinických prací, ve kterých autoři prokázali vyšší četnost primárně ankylotických dočasných molárů a stálých prvních molárů u dvojčat, ale jednoznačně zodpovědné geny nezmiňují [9, 10, 11].
Vznik sekundární pozdní ankylózy souvisí se známými etiologickými faktory. Jednou z jejích hlavních příčin je trauma, které vede k poranění periodontálního aparátu (subluxace, luxace nebo avulze zubu). Nejčastěji postiženým zubem bývá horní první stálý řezák [12] (Obr. 3).
Luxační poranění je přitom jedním z nejběžnějších úrazů zubů zejména v dětské populaci, s četností od 30 % do 44 % všech případů zubního traumatu a postihuje přibližně 6 % populace [13]. Hlavním etiologickým faktorem vzniku ankylózy po traumatu se udává doba expozice zubu suchému prostředí (riziko roste s délkou expozice). Autoři také konstatují, že riziko je signifikantně vyšší u zubů stálých, pravděpodobně vzhledem k faktu, že periodontální ligamenta jsou tenčí u zubů s ukončeným vývojem kořene, proto dochází rychleji k jejich poškození. U zubů vystavených suchému prostředí méně než 20 minut došlo k ankylotickému procesu u 34 % dočasných a 55 % stálých zubů [14]. Avulze zubu a vystavení kořene suchému prostředí během kritického období transportu pacienta má za následek smrt buněk na povrchu kořene [15]. Kromě relativně těžkého traumatu zubu, může vzniknout poškození kořene i po mechanickém poranění lehčího stupně. Difuzní poškození kořene postihující více než 20 % povrchu kořene zubu vede ke vzniku reaktivní zánětlivé odpovědi, u které je iniciován proces hojení [16, 17, 18]. Výsledkem jsou okrsky dentinu s chybějícím cementem, které jsou náchylnější k migraci kostních buněk osteoblastické řady než pomalejších fibroblastů a cementoblastů, a dochází tak k přímému spojení kořene s kostí. Kořen zubu se stává součástí kostní tkáně, kdy osteoklasty a osteoblasty nahrazují vlastní zubní tkáň prostřednictvím progresivního nezánětlivého remodelačního procesu [19].
Na zvířecích modelech bylo zjištěno, že topická aplikace léčiv jako jsou dexametason (tlumení zánětlivé reakce) nebo alendronát (omezení kořenové resorpce) do luxačního lůžka, které měly přispět k prevenci vzniku ankylózy u replantovaných zubů, nebyla účinná [20, 21]. Dalším preparátem, který byl zkoušen jak na zvířecím modelu, tak i u lidí v rámci replantace zubů, je Emdogain gel (směs proteinu amelogeninu získaného ze zubních zárodků selat s propylenglykolovým gelem), u kterého výsledky ukazují, že sice pomáhá s hojením periodoncia, ale není plně účinný v prevenci rozvoje ankylózy [22, 23, 24].
V současnosti by mezi slibnou metodu mohla patřit aplikace fibrilinu, což je extracelulární protein produkovaný fibroblasty lokalizovanými v závěsném aparátu zubu, jelikož fibrilin tvoří hlavní složku mikrofibril v periodontálních vláknech. Právě přítomnost fibrilinu se ukazuje jako klíčová pro tvorbu a regeneraci periodontálních vláken a zároveň vede k potlačení aktivity osteoblastů a tím tvorby kosti. Tyto výsledky mohou naznačovat, že dostatečné množství fibrilinu v periodontální štěrbině by mohlo vytvářet vhodné prostředí v prevenci vzniku ankylózy u replantovaných zubů [24].
K iniciaci ankylózy může dojít i po rozsáhlé nekróze periodontálních ligament z důvodu subluxace zubu s následnou formací kosti v oblasti jeho kořene [25]. Dle literatury, ale i našich klinických zkušeností, se ukazuje, že dentální trauma je jedním z důležitých faktorů při vzniku zubní ankylózy.
Ankylóza byla pozorována i jako sekundární jev u retinovaných zubů při nebo po ortodontické terapii. Jedním z možných vysvětlení je chemické poškození cementosklovinného spojení leptadlem v průběhu adaptace zámku při chirurgickém výkonu [26] nebo mechanické poškození této oblasti během expozice zubu. Dalším faktorem může být působení velké ortodontické síly, která způsobí povrchovou resorpci. Tato mikrotraumata v oblasti periodontální štěrbiny mohou být poté nahrazována kostní tkání a tím dojde k vytvoření ankylózy [27, 28]. Zajímavostí je, že někteří autoři dokonce využívají ankylotické moláry v dočasné dentici jako kotevní prvek k ortodontickým tahům stálých molárů [29]. Etiologie vzniku ankylózy při ortodontické léčbě nicméně není ani zdaleka jasná a je rovněž zapotřebí dalšího výzkumu.
Mezi jiné příčiny vzniku ankylózy můžeme zařadit extrémní žvýkací tlak na daný zub, chronický zánět v oblasti periodoncia nebo kombinaci obou faktorů [28, 30]. Sekundární retence následkem ankylózy byla asociovaná i s lokální infekcí způsobenou virem Varicella zoster, který poškozuje inervaci zubu a/nebo i zubní folikul [31].
Diagnostika
Diagnostika ankylózy je založená na anamnéze a klinickém obraze, který je charakteristický ztrátou mobility ankylotického zubu. U prořezaného zubu můžeme sledovat jeho postupné zanořování, což vede k infraokluzi postiženého zubu. Dalším klinickým příznakem může být absence ortodontického pohybu zubu, což se v praxi dá využít jako pevný kotevní prvek k případnému posunu ostatních zubů v rámci ortodontické léčby [32, 33]. Dalším příznakem ankylózy u prořezaného zubu může být charakteristický (jasný, ostrý) zvuk při perkusním vyšetření [34].
V případě retinovaného zubu je samozřejmě posouzení mobility zubu a diagnostika na základě perkusního testu neproveditelná.
Důležitým pomocným vyšetřením při diagnostice zubní ankylózy je rentgenologické vyšetření. Běžně používané zobrazovací metody, jako intraorální snímek nebo ortopantomogram (OPG), jsou považovány za nedostačující ke správné diagnostice ankylózy zubu [35]. Tyto rentgenové snímky zobrazují zuby ve 2D projekci, tedy pokud se ankylóza nachází na orální nebo vestibulární části kořene zubu nebo jsou přítomny pouze malé okrsky ankylózy, poskytují vysokou míru falešně negativních výsledků [8]. V klinické praxi je nejlepší metodou k diagnostice ankylózy CT vyšetření [36]. Při indikaci tohoto vyšetření je nicméně potřeba zvážit vyšší radiační zátěž pro pacienta. Je proto nahrazováno metodou CBCT, které má nižší radiační zátěž. Navíc, CBCT vyšetření může být nápomocné při diagnostice ankylózy, ale není doporučeno jako jediný diagnostický nástroj vzhledem k možným falešně pozitivním výsledkům, proto musí být doplněno i o klinické vyšetření pacienta [35].
Dalším potenciálně vhodným diagnostickým nástrojem pro identifikaci ankylotických zubů může být použití speciální sondy. Ta se přiloží na povrch korunky zubu a poté vysílá akcelerometrické signály, které zpětně analyzuje. Toto vyšetření se dnes využívá především pro hodnocení pevnosti spojení zubního implantátu a kosti [28, 37].
Terapie
Při plánování léčby je důležité rozlišovat mezi primárním selháním erupce (PSE) a ankylózou.
U PSE, na rozdíl od ankylózy, nedochází k fúzi kosti a cementu, ale k narušení samotného erupčního mechanismu, které vede k retenci zubu. Postižené jsou primárně distální zuby, nejvíce moláry a obecně všechny zuby uložené za nejmeziálnějším postiženým zubem. Zuby nemusí reagovat na ortodontické síly a po jejich aplikaci mohou mít vyšší sklon ke vzniku ankylózy [38]. K rozlišení PSE a ankylózy by v budoucnu mohlo pomoci genetické testování mutace PTH1R. Negativní test PTH1R nicméně nevylučuje možnost PSE s jinou doposud neznámou mutací [39].
U ankylózy je léčba relativně komplikovaná a často končí extrakcí postiženého zubu, aby se předešlo vzniku malokluze a laterálně otevřeného skusu (jako následku poruchy vertikálního růstu alveolární kosti v oblasti ankylotického zubu) [40].
U neprořezaných zubů je vhodné (pokud to vůbec lze) odlišit primární selhání erupce a ankylózu zubu. Proto je vhodné zhotovení CBCT s trojdimenzionální rekonstrukcí a analýzou snímků, které by mohlo vyloučit případnou idiopatickou ranou ankylózu [35]. V případě absence ortodontického posunu po chirurgické intervenci a po potvrzení diagnózy ankylózy je doporučena jeho extrakce [41].
Mezi další terapeutické metody patří chirurgická subluxace ankylotického zubu s případnou kortikotomií okolo a následný pokus o zařazení ankylotického zubu do zubního oblouku pomocí ortodontického tahu [35] (Obr. 4) nebo osteotomie kosti okolo ankylotického zubu s následnou alveolární distrakcí pomocí ortodontického tahu [42, 43, 44]. Komplikací těchto postupů však může být fraktura kořene, opětovné ankylotické spojení zubu s kostí v nevyhovující pozici nebo poškození okolních struktur [42].
Studium procesů vedoucích ke vzniku ankylózy s využitím myších modelů
Ačkoli je acelulární cement nezbytný pro uchycení zubu, faktory, které řídí jeho vývoj a regeneraci, zůstávají nedostatečně pochopeny. Vývoj a udržování mineralizovaných tkání v ústní dutině jsou silně ovlivněny poruchami v metabolismu anorganického pyrofosfátu (PPi) [45]. Fyziologická mineralizace je regulována rovnováhou mezi extracelulárními koncentracemi anorganického fosfátu (Pi), substrátu pro mineralizaci, a anorganického pyrofosfátu [46], inhibitoru mineralizace, který je klíčovým regulátorem tvorby cementu [47]. Tloušťka acelulárního cementu je nepřímo úměrná hladinám PPi. Jeho lokální koncentrace je určena několika klíčovými faktory, a to progresivním zvýšením tkáňově nespecifické alkalické fosfatázy (TNAP), ankylózním proteinem (ANK) a ektonukleotid pyrofosfatázou/fosfodiesterázou 1 (ENPP1) [45]. Tkáňová nespecifická alkalická fosfatáza (ALPL gen; TNAP protein) je enzym, známý především pro svou nezbytnou roli v mineralizaci skeletu a zubů. Mineralizace je podpořena hydrolýzou PPi za současného vytváření Pi. Degradací anorganického fosfátu prostřednictvím TNAP dochází ke změně poměru Pi/PPi směrem k mineralizaci[48]. Mutace v genu ALPL, který kóduje protein TNAP, vedou k těžké hypofosfatázii. Mají také za následek silně sníženou mineralizaci [49]. Progresivní ankylózní protein (ANK nebo také ANKH gen; ANK protein) je transmembránový protein, který zprostředkovává transport intracelulárního PPi do extracelulárního prostředí [50]. Rovněž je důležitým regulátorem extracelulární homeostázy PPi v kosterních tkáních [51, 52, 53]. Ektonukleotid pyrofosfatáza/fosfodiesteráza 1 (ENPP1 gen; ENPP1protein) je membránově vázaný glykoprotein, který reguluje mineralizaci kostí hydrolýzou extracelulárních nukleotidových trifosfátů (NTP), za vzniku Ppi [54]. Zatímco TNAP pozitivně reguluje mineralizaci hydrolýzou NTP a PPi za vzniku Pi, ENPP1 negativně reguluje mineralizaci kostí hydrolýzou extracelulárních NTP za vzniku Ppi [46, 55]. Dysfunkce ENPP1 mimo jiné způsobuje onemocnění charakterizovaná ektopickou kalcifikací [54]. Jak již bylo zmíněno, ztráta funkce některého z těchto proteinů vede k dysregulaci mineralizace a může tudíž vést k ankylóze zubního kořene [47, 56].
V rámci studií zaměřených na vliv anorganického pyrofosfátu a tvorbu acelulárního cementu bylo již dříve vytvořeno několik geneticky upravených myších modelů, kde byly hladiny PPi změněny celkovou eliminací daného genu[57]. Myší model s delecí neboli knockoutem (KO) genu Alpl, tedy Alpl KO mají zvýšené hladiny PPi a vykazují nedostatek acelulárního cementu, stejně jako další závažné poruchy mineralizace [58, 59, 60, 61, 62]. Nadbytek PPi u Alpl KO myši měl škodlivé účinky na všechny dentoalveolární tkáně, jako je sklovina, dentin, cement a alveolární kost [58, 59, 61, 63, 64].
Oproti tomu myši Ank KO vykazovaly snížené hladiny extracelulárního PPi. Ank KO, ve srovnání s kontrolními jedinci (wild type - WT) rychle tvoří neobvykle tlustý acelulární cement, zatímco jiné dentoalveolární tkáně byly relativně neovlivněny [57, 59, 65]. Obdobných výsledků bylo dosaženo při deleci Enpp1 [58, 59, 65, 66]. Simultánní delece Ank a Enpp1 nerozšířila růst acelulárního cementu nad rámec pozorovaný u jednotlivých typů KO myší, ale ani nevedla k ankylóze [45]. Současná ablace Ank a Enpp1 nevedla k další expanzi růstu acelulárního cementu. Existuje tedy limitace jejich účinku, která vede ke snížení hladiny PPi a růstu acelulárního cementu, přičemž proteiny ANK a ENPP1 mají podobný mechanismus působení spíše než aditivní nebo synergický účinek [66]. U lidí jsou mutace se ztrátou funkce v ENPP1 nebo ANK proteinech spojeny s indukcí ankylóz, opožděnou erupcí zubu, narušenou primární exfoliaci zubů, malokluzí a pomalým ortodontickým pohybem [67]. Zda ANK a ENPP1 působí nějakým vzájemně závislým mechanismem, je důležitou otázkou, kterou bude nezbytné dále zodpovědět [45].
Při duální genetické modulaci genů Ank a Alpl (Ank, Alpl dKO - double knockout) [57], byly hladiny PPi normalizovány. Rovněž došlo k obnovení acelulárního cementu, stejně jako funkce periodoncia. Naproti tomu sklovina, dentin a alveolární kost vykazovaly u Ank, Alpl dKO myší velmi omezené nebo žádné zlepšení, se zjevnými podstatnými deficity v objemech tkání a minerálních hustotách. Tyto účinky jsou v souladu se zjištěními, že myši Ank, Alpl dKO a primární osteoblasty in vitro nevykazovaly úplnou korekci mineralizačního fenotypu [57], což potvrzuje výjimečnou citlivost acelulárního cementu na přímou modulaci Ppi [68, 69, 70, 71]. Výsledky experimentů tedy poskytují důkaz, že zvýšení, snížení nebo normalizace hladin PPi prostřednictvím genetické ablace Alpl a/nebo Ank může změnit expresi genů/proteinů cementu a předvídatelně určit tloušťku acelulárního cementu [56].
Aby parodontální aparát zůstal funkční, musí být rovněž udržovány hranice tvrdé a měkké tkáně na rozhraní cement-PDL a kost-PDL[59, 65, 66, 72, 73]. Navzdory zvýšené hladině cementu pozorovaného u myší s Ank KO, Enpp1asj/asj a dKO ve srovnání s kontrolami WT zůstalo uložení, šířka i objem PDL normální. Nebyly pozorovány žádné rozdíly ani v hustotě tkáně. Nicméně u Ank KO, Enpp1asj/asj a dKO myší byly přítomny cementikly v parodontu. U Enpp1 mutantní myši v porovnání s WT se vyvinula ankylóza mezi cementem a alveolární kostí. Tyto nálezy o cementiklech a ankylóze podporují, že ANK a ENPP1 a zvýšené hladiny PPi hrají roli při udržování hranic mineralizovaných tkání v parodontu [45].
Genetická modulace PPi prostřednictvím delece Alpl, Ank a/nebo Enpp1 výrazně ovlivňuje růst acelulárního cementu během vývoje. Tato zjištění podporují využití PPi jako nového terapeutického přístupu s klinickou aplikací k podpoře cementogeneze v podmínkách ztráty parodontu nebo k ochraně proti ankylóze[45]. Dle studie podávání fúzního proteinu ENPP1-Fc korigovalo hladiny PPi a zeslabilo acelulární cementogenezi, což dokazuje, že tkáň je přístupná modulaci PPi po celý život. Ankylóza byla zlepšena u mutantů Enpp1, kterým byl podáván ENPP1-Fc, což ukazuje potenciál pro tento přístup ke kontrole ektopické kalcifikace v periodontálních tkáních [68, 69, 70, 71].
Závěr
Mechanismus vzniku ankylózy na molekulární úrovni zatím není zcela jasný. Diagnostika idiopatické rané (tj. primární) ankylózy nadále zůstává výzvou a v klinické praxi na ni musí zubní lékař nebo ortodontista myslet a v terapeutickém plánu s ní počítat. Sekundární pozdní ankylóza je většinou důsledkem patologických stavů, jakými jsou úrazy zubů či zánětlivé komplikace zubního kazu. Jejich prevence a případně časná léčba tak může následky tohoto závažného postižení zubu velmi významně redukovat. Další výzkum ankylotických procesů na úrovni experimentálních modelů i klinických studií je nezbytný pro lepší pochopení příčin jejich vzniku, časnější diagnostiku i účinnější léčbu.
Tento článek vznikl za grantové podpory: AZV/ NU20-06-00189/2020 Ministerstva zdravotnictví České republiky a RVO/FNO 2021.
Autoři nemají komerční, vlastnické nebo finanční zájmy na produktech nebo společnostech popsaných v tomto článku.
Introduction
A healthy tooth root is fixed to the bone with periodontal fibres forming flexible anchorage enabling teeth to better resist pressure resulting from mastication. Pathological processes (e.g. inflammation or trauma) or even clearly identified causes may lead to blood coagulation in the periodontal fissure and subsequently to the formation of granulation tissue that can gradually ossify. In this way, the periodontal fissure is lost and the root surface fuses with the alveolar bone, i.e. ankylosis [1, 2] (Fig. 1).
Etiology and incidence
Permanent teeth ankylosis is a multifactorial condition; due to the difficult diagnosis, the precise cause and prevalence in the population remain unclear.
The incidence of ankylosis is ten times higher in deciduous dentition than in permanent dentition (Fig. 2) and twice as common in the mandible as in the maxilla. The lower second deciduous molars are the most frequently affected teeth. However, ankylosis may occur in permanent dentition as well. There is no significant difference in the occurrence between men and women. In children and adolescents, the first permanent molar is the most often affected [3], which complicates orthodontic treatment. In adults, impacted canines are the most often affected [4].
Ankylosis is currently classified into idiopathic (early) and secondary (late) ankylosis. The causes of idiopathic ankylosis have not been satisfactorily explained. Congenital factors that participate in the formation of periodontium and bone are considered, which is supported by the increased occurrence of a rare form of CLCN-7 osteopetrosis among patients with tooth ankylosis. This is the result of the disturbance of H(+)-ATPase on the osteoclast membrane that allows the exchange of hydrogen and chloride ions. Even if the number of osteoclasts is sufficient, they are not able to release hydrogen ions reducing pH in the extracellular spaces, and thus, they contribute to bone resorption [5, 6]. In a mouse model with this mutation, disturbances in teeth eruption, changes in the roots shape, ankylosed fusion of the roots with alveolar bone, and under developed periodontal ligaments in the gene mutation were described [7].
Another explanation of tooth ankylosis is offered by the so-called metabolic theory [3], which supposes damaged periodontal cell membrane due to local changes in the cellular metabolism. Periodontal fibres are gradually resorbed and replaced with bone tissue [8]. Several clinical studies proved a higher incidence of primary ankylosed deciduous molars and permanent first molars in twins. However, they did not determine the responsible genes [9, 10, 11].
Secondary (late) ankylosis is associated with well-known etiological factors. Trauma resulting in the injury of periodontal apparatus (tooth subluxation, luxation or avulsion) is one of these. Maxillary first permanent incisors are the most often affected tooth [12] (Fig. 3).
Luxation is one of the most common injuries to teeth, especially in children, representing 30 % - 44 % of all dental traumas, and is present in approx. 6 % of the population [13]. The duration of tooth exposure to the dry environment is considered the main etiological factor of ankylosis after trauma (the risk increases with longer exposition). The authors also state that the risk is significantly higher in permanent dentition, probably due to the fact that periodontal ligaments in the teeth with completed root development are thinner and, thus, are more easily damaged. In teeth exposed to a dry environment for less than 20 minutes, ankylosis occurred in 34% of deciduous and 55% of permanent teeth [14]. Tooth avulsion and exposure of the root to dry environment during the critical period of the patient transport results in the death of cells on the root surface [15]. Apart from the relatively severe tooth trauma, the root may be damaged after even a slight mechanical injury. Diffused damage to the root affecting more than 20% of the root surface results in an inflammatory response, in which the process of healing is initiated [16, 17, 18]. This results in the formation of areas of dentin with missing cement that are more prone to the migration osteoblasts than of fibroblasts and cementoblasts, which leads to a direct fusion of the root with the bone. The tooth root becomes a part of the bone tissue, with osteoclasts and osteoblasts replacing the dental tissue through progressive non-inflammatory remodeling processes [19].
Experiments on animal models showed that topical medication, such as dexamethasone (to suppress inflammatory response) or alendronate (to restrict root resorption) applied to the site of luxation that was expected to prevent ankylosis in impacted teeth, was not effective [20, 21]. Another medication tested during teeth replanting both on animals and humans, Emdogain gel (amelogenin protein obtained from dental germs of piglets in a propyleneglycol gel) showed promising results in healing periodontium; it was, however, not fully effective in the prevention of ankylosis [22, 23, 24].
Currently, the application of fibrillin, an extracellular protein produced by fibroblasts located in the periodontium, seems to be a promising method. Fibrillin is the main part of microfibrils in periodontal fibres. The presence of fibrillin appears to be the key factor in the formation and regeneration of periodontal fibres, and, at the same time, it suppresses the osteoblast activity and, therefore, bone formation. The results suggest that sufficient amounts of fibrillin in periodontal fissures may create an appropriate environment for preventing ankylosis in replanted teeth [24].
Ankylosis may be initiated following extensive necrosis of periodontal ligaments due to tooth subluxation with further formation of the bone in the area of the tooth root [25]. Literature as well as our clinical experience show that dental trauma is one of the most important factors of dental ankylosis.
Ankylosis was also observed as a secondary phenomenon in impacted teeth or during/after orthodontic therapy. This may be explained by chemical damage to the cemento-enamel junction caused by an etchant during the adjustment of brackets in surgical management [26] or mechanical damage during the tooth exposure. Great orthodontic forces may constitute another factor that may cause surface resorption of the root. Such microtraumas in the region of the periodontal fissure may be ossified, and ankylosis occurs [27, 28]. It is interesting that some authors use ankylosed molars in deciduous dentition as anchorage for orthodontic traction of permanent molars [29]. Nevertheless, the etiology of ankylosis during orthodontic treatment is not clear, and further research is necessary.
Other causes of ankylosis include extreme mastication pressure on a given tooth, chronic inflammation in the region of the periodontium, or a combination of both factors mentioned [28, 30]. Secondary impaction due to ankylosis was associated also with local infection caused by Varicella zoster that damages tooth innervation and/or tooth follicles [31].
Diagnosis
Diagnosis of ankylosis is based on the patient’s medical history and clinical picture, which is characterized by the loss of mobility of the ankylosed tooth. In an erupted tooth, we can observe its gradual reinclusion leading to its infraocclusion. The absence of orthodontic movement of the tooth is another common diagnostic indicator. This can be in practice utilized as ankylosed tooth forms a firm anchorage element that can be used for the potential shift of other teeth within orthodontic treatment [32, 33]. A characteristic (clear, sharp) sound on percussion is another typical symptom of ankylosis in an erupted tooth [34].
In the case of an impacted tooth, however, the assessment of the tooth mobility and percussion tests cannot be used.
Radiographic examination is an important additional test in the diagnosis of dental ankylosis. Common imaging methods, such as intraoral X-ray or OPG, are considered insufficient for the correct diagnosis of tooth ankylosis [35]. X-rays depict the teeth in a 2D projection; in effect, if ankylosis is in the oral or vestibular part of the root or if only small areas of ankylosis are present, there is a high rate of false negative results [8]. In clinical practice, CT examination is the best imaging method for ankylosis [36]. However, as it is associated with a higher radiation load, it is often replaced with CBCT, the radiation load of which is lower. Nevertheless, although CBCT may help in the diagnosis of ankylosis, it is not recommended as the single tool of diagnostics due to the possible false positive results. Therefore, it must be accompanied by clinical examination [35].
Another convenient diagnostic tool is the use of aspecial probe that sends accelerometric signals from the tooth crown into the tooth and performs feedback analysis. This examination is used to assess the firmness of the junction between the dental implant and the bone [28, 37].
Therapy
When planning the treatment, it is important to differentiate between primary failure of tooth eruption (PFE) and ankylosis. In PFE, unlike in ankylosis, there is no fusion between the bone and the cement, the impaction is caused by the disrupted eruption mechanism. Primarily, distal teeth are affected, most often molars, and, more generally, all teeth located beyond the most mesially located affected tooth. The PFE teeth may not respond to orthodontic forces and may show an increased tendency to ankylosis [38]. Genetic testing of PTHIR can help to differentiate between PFE and ankylosis in the future. Nevertheless, negative PTHIR tests do not exclude PFE with another, still non-identified mutation [39].
The treatment of ankylosis is rather complicated and very often, it is resolved by extraction of the affected tooth to prevent malocclusion and laterally open bite (as the result of vertical disruption of the alveolar bone growth in the area of the ankylosed tooth) [40].
In the case of unerupted teeth, it is also advisable to differentiate between the primary failure of eruption and ankylosis. Therefore, it is recommended to perform CBCT with 3D reconstruction and analysis of scans to exclude idiopathic (early) ankylosis [35]. If no orthodontic movement is observed even after surgical exposure of the tooth, it is necessary to focus on confirming or disproving ankylosis; if ankylosis is confirmed, extraction is recommended [41].
Other treatment methods include surgical subluxation of the ankylosed tooth with a potential corticotomy and a subsequent attempt to align the ankylosed tooth to the dental arch with orthodontic traction [35] (Fig. 4), or osteotomy of the bone surrounding the ankylosed tooth with subsequent alveolar distraction with orthodontic traction [42, 43, 44]. Complications may involve root fracture, repeated ankylosed fusion of the tooth with the bone in undesirable position, or damage to adjacent structures [42].
Study of the processes resulting in ankylosis on mice models
Though the acellular cement is necessary for tooth anchorage, factors that influence its development and regeneration are not fully understood. The development and maintenance of mineralized tissues in the oral cavity are affected by disturbances in the metabolism of inorganic pyrophosphate (PPi) [45]. Physiological mineralization is controlled by the balance between the extracellular concentrations of inorganic phosphate (Pi), substrate for mineralization, and PPi [46], the inhibitor of mineralization, which acts as the key regulator of cement formation [47]. The thickness of acellular cement is inversely proportional to the PPi levels. The local concentration is determined by several key factors, including the progressive increase in non-specific alkalic phosphatase (TNAP), ankylose protein (ANK), and ectonucleoitid pyrophosphatase/ phosphodiesterase 1 (ENPP1) [45].
Tissue non-specific alkalic phosphatase (ALPL gene; TNAP protein) is an enzyme known for its role in the mineralization of skeleton and dentition. Mineralization is supported by PPi hydrolysis and the formation of Pi. Degradation of inorganic phosphate through TNAP changes the Pi/Ppi ratio towards mineralization [48]. Mutations in the ALPL gene encoding the TNAP protein result in severe hypophosphatasia. They also lead to severely reduced mineralization [49]. The progressive ankylosed protein (ANK or ANKH gene; ANK protein) is a transmembrane protein enabling the transportation of intracellular PPi into the extracellular environment [50]. It is also an important regulator of extracellular homeostasis of PPi in skeletal tissues [51, 52, 53]. Ecto-nucleoide pyrophosphatase/phosphodiesterase 1 (ENPP1 gene; ENPP1 protein) is a membrane-bound glycoprotein regulating bone mineralization through hydrolysis of extracellular nucleotide triphosphates (NTP) to form PPi [54]. While TNAP positively regulates mineralization by hydrolysis of NTP and PPi accompanied by the occurrence of Pi, ENPP1 negatively regulates bone mineralization by hydrolysis of extracellular NTP with the occurrence of PPi [46, 55]. ENPP1 dysfunction causes conditions characterized by ectopic calcification [54]. As mentioned above, loss of function of any of these proteins leads to dysregulation of mineralization and may, therefore, lead to tooth root ankylosis [47, 56].
As a part of studies focused on the impact of inorganic pyrophosphate and the formation of acellular cement, several genetically modified mice models with levels of PPi altered by the total elimination of particular genes were previously created [57]. Mice models with deletion or knockout (KO) of the Alpl gene (Alpl KO) have increased levels of PPi and show the lack of acellular cement as well as other severe disturbances of mineralization [58, 59, 60, 61, 62]. Excess PPi in Alpl KO mice showed damage to all dentoalveolar tissues, such as enamel, dentin, cement, and alveolar bone [58, 59, 61, 63, 64].
On the contrary, mice Ank KO showed decreased levels of extracellular PPi. In comparison with control individuals (wild type – WT) Ank KO quickly formed unusually thick acellular cement, while other dentoalveolar tissues remain relatively unaffected [57, 59, 65]. Similar results were achieved in Enpp1 deletion [58, 59, 65, 66]. Simultaneous deletion of Ank and Enpp1 did not extend the growth of acellular cement above the scope observed in individual types of KO mice, and did not lead to ankylosis [45]. The simultaneous ablation of Ank and Enpp1 did not result in the expansion of the acellular cement growth. Thus, their effects are limited and the limitation leads to decreased levels of PPi as well as to the growth of acellular cement. ANK and ENPP1 proteins have, therefore, similar mechanisms of effect rather than additive or synergic effects [66]. In humans, loss of function mutations in ENPP1 or ANK proteins are associated with development of ankylosis, delayed tooth eruption, disturbed primary exfoliation of teeth, malocclusion, and slow orthodontic movement [67]. Whether ANK and ENPP1 work on the basis of some mutually related mechanism or not, is an important question that must be addressed [45].
In the case of dual genetic modulation of the Ank and Alpl genes (Ank, Alpl dKO – double knockout mice) [57] the levels of PPi were normal. Acellular cement as well as the function of periodontium was restored. On the contrary, enamel, dentin, and alveolar bone in Ank, Alpl dKO mice showed no or only very limited improvement, with obvious substantial deficits in the volumes of tissues and in the density of minerals. These findings correspond to the facts that neither Ank, Alpl dKO mice nor primary osteoblasts in vitro showed total correction of mineralization phenotype [57], which confirms the extraordinary sensitivity of acellular cement on the direct PPi modulation [68, 69, 70, 71]. The results of experiments prove that the increase, decrease, or normalization of PPi levels through genetic ablation Alpl and/or Ank can change the expression of genes/proteins regulating cement, and predictably determine the thickness of acellular cement [56].
For the periodontium to remain functional, the borderline between hard and soft tissues on the boundary between cement-PDL and bone-PDL must be maintained [59, 65, 66, 72, 73]. Despite the increased level of cement observed in mice with Ank KO, Enpp1asj/asj, and dKO, the location, width, and volume of PDL remained normal (in comparison with the control group – WT). No differences were found in the tissue density. Nevertheless, in Ank KO, Enpp1asj/asj, and dKO mice, cementicles were found in the periodontium. In comparison with WT, ankylosis between cement and alveolar bone occurred in Enpp1 mutant mice. The findings of ankylosis and cementicles suggest that ANK, ENPP1, and increased levels of PPi play a role in maintaining the borders of mineralized tissues in periodontium [45].
Genetic modulation PPi through deletion of Alpl, Ank, and/or Enpp1 has a significant impact on the growth of acellular cement during development. These findings support the use of PPi as a new therapeutic approach with clinical application to support cementogenesis and prevent ankylosis [45]. According to that study, the administration of fusion protein ENPP1-Fc corrected the levels of PPi and reduced acellular cementogenesis, which proves that the tissue is open to PPi modulation during the whole life. Ankylosis was improved in Enpp1 mutants who were administered ENPP1-Fc, which shows the role this approach could play in the control of ectopic calcification in periodontal tissues [68, 69, 70, 71].
Conclusion
The mechanism of the origins of tooth ankylosis on the molecular level is still unclear. Diagnostics of idiopathic early (ie. primary) ankylosis remains a challenge and in clinical practice, dentists and orthodontists have to consider it and make it a part of the treatment plan. Secondary late ankylosis is mostly the result of pathologies, such as dental trauma or inflammatory conditions associated with caries. Prevention and early treatment may significantly reduce the impact of this severe condition. Further research focused on ankylosis using experimental models as well as clinical experience is necessary in order to better understand causes, to speed up the diagnostic process, and to provide more effective therapy.
This article was sponsored by the grant: AZV/ NU20-06-00189/2020 Ministry of Health Service of Czech Republic and RVO/FNO 2021.
Authors have no commercial, proprietary or financial interests in products or companies mentioned in the article.
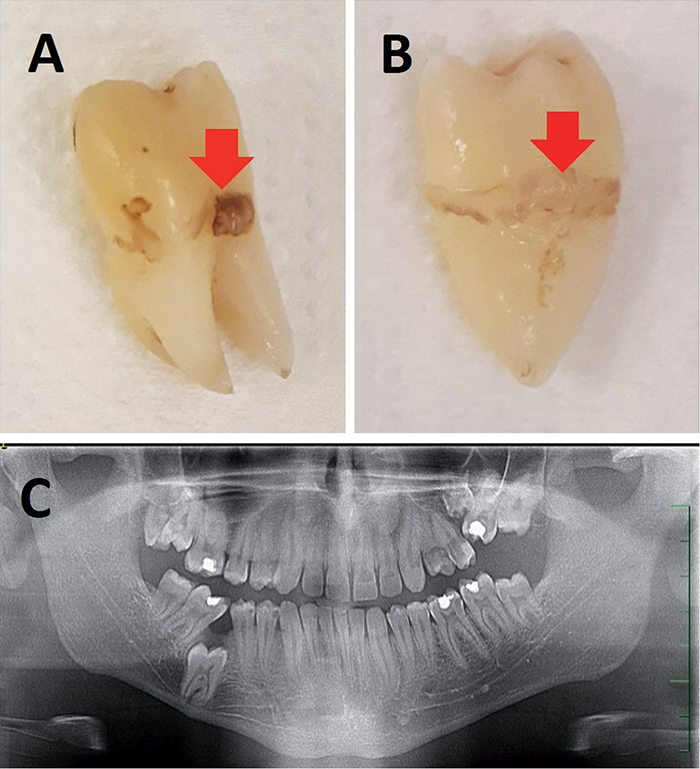
Obr. 1 / Fig. 1
A) Retinovaný zub 46 s idiopatickou ankylózou u 19letého pacienta – šipka ukazuje kostní tkáň na kořenu extrahovaného zubu. B) Retinovaný zub 26 opět s idiopatickou ankylózou u stejného pacienta – šipka ukazuje kostní tkáň na kořenu extrahovaného zubu. C) OPG stejného pacienta, kde jsou vidět neprořezané zuby 46, 26 s idiopatickou ankylózou. V dolní čelisti je neprořezání zubu 46 kompenzováno meziálním sklonem zubu 47 / A) Impacted tooth 46 with idiopathic ankylosis in a 19-year-old patient – the arrow points to the bone tissue at the root of the extracted tooth. B) Impacted tooth 26 with idiopathic ankylosis in the same patient – the arrow points to the bone tissue on the root of the extracted tooth. C) OPG of the same patient showing unerupted teeth 46 and 26 with idiopathic ankylosis. The unerupted tooth 46 is compensated by the mesial inclination of the tooth 47.
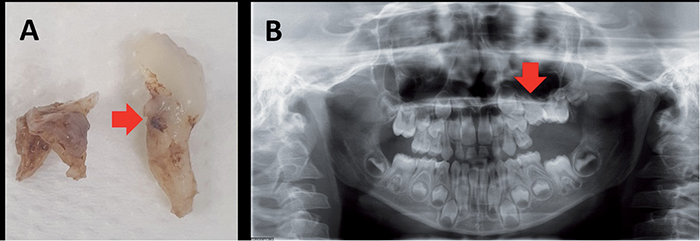
Obr. 2 / Fig. 2
A) Ankylotický dočasný druhý molár vlevo u 7letého pacienta – ankylóza byla potvrzena při komplikované extrakci v celkové anestezii na vestibulární a distální části kořene – šipka ukazuje kostní tkáň na kořenu extrahovaného zubu. B) OPG stejného pacienta s patrnou retencí zubu 65 (červená šipka). Jednoznačná ankylóza kořene zde není patrná / A) Ankylosed deciduous second molar on the left in a 7-year-old patient – ankylosis was revealed during the complicated extraction performed in general anesthesia on vestibular and distal parts of the root – the arrow points to the bone tissue on the root of the extracted tooth. B) OPG of the same patient with visible impaction of the tooth 65 (red arrow). Clear root ankylosis is not apparent.
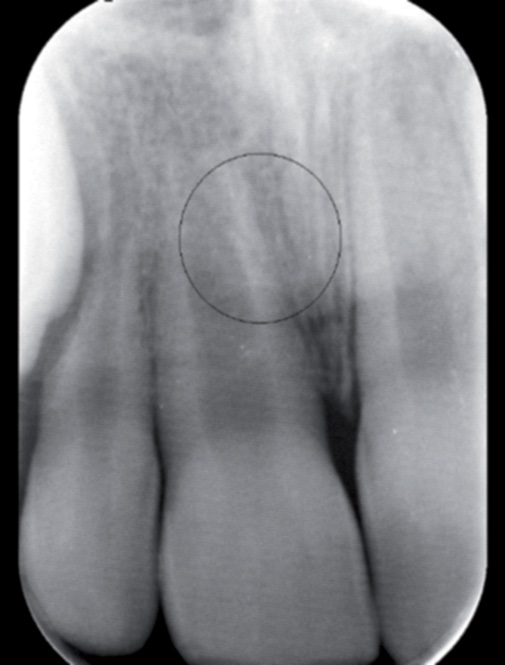
Obr. 3 / Fig. 3
Intraorální RTG snímek 8letého pacienta zhotovený 3 měsíce po avulzi zubu 11. Na snímku je patrná ankylóza kořene zubu 11 s nedokončeným vývojem kořene a vymizelou periodontální štěrbinou (v kroužku). Klinicky byl přítomen jasný zvuk při perkusi / Intraoral radiograph of an 8-year-old patient taken 3 months after the tooth 11 avulsion. We can see ankylosed tooth 11 root with incomplete root development and lost periodontal fissure (in the circle). In percussion we heard a clear sound.
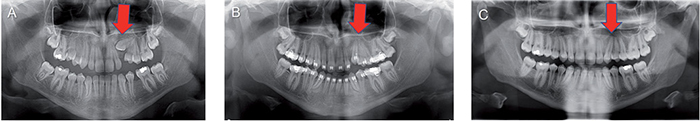
Obr. 4 / Fig. 4
A) Retinovaný zub 23 u 15letého pacienta, u kterého byla provedena chirurgická expozice zubu 23 otevřenou metodou a nasazen ortodontický tah. B) Zastavení ortodontického pohybu u zubu 23 těsně před zařazením po 14 měsících terapie, kdy byl proveden druhý výkon v podobě chirurgické subluxace. C) Zařazení zubu 23 do zubního oblouku po kortikotomii se subluxací, která proběhla po 22 měsících od expozice zubu / A) Impacted tooth 23 in a 15-year old patient after surgical exposition of the tooth 23 with open method and adjustment of orthodontic force. B) Stop of orthodontic movement of the tooth 23 immediately before the inclusion after 14 months of therapy, when surgical subluxation was performed. C) Alignment of the tooth 23 into the dental arch after corticotomy with subluxation performed 22 months after the tooth exposition.

Literatura / References
1. Andersson L, Malmgren B. The Problem Of Dentoalveolar Ankylosis And Subsequent Replacement Resorption In The Growing Patient. Australian Endodontic J. 1999;25(2):57–61. doi: 10.1111/j.1747-4477.1999.tb00088.x.
2. Lucas PW. Principles of tooth design, Teeth, Form, Function. Evolution in: Kurten, B. (Ed.). Columbia Univ. Press, New York, 1979;p154.
3. Biederman W. Etiology and treatment of tooth ankylosis. Amer. J. Orthodont. 1962;48(9): 670–684. doi: 10.1016/0002-9416(62)90034-9.
4. Becker A, Chaushu S. Success rate and duration of orthodontic treatment for adult patients with palatally impacted maxillary canines. Amer. J. Orthodont. Dentofacial Orthoped. 2003;124(5):509–14. doi: 10.1016/S0889-5406(03)00578-X.
5. Sobacchi C, Villa A, Schulz A, Kornak U. CLCN7-Related Osteopetrosis, in GeneReviews®, M. P. Adam, G. M. Mirzaa, R. A. Pagon, S. E. Wallace, L. J. Bean, K. W. Gripp, and A. Amemiya, Eds., Seattle (WA): University of Washington, Seattle, 1993. Accessed: Apr. 05, 2023. [Online]. Available: http://www.ncbi.nlm.nih.gov/books/NBK1127/
6. Kornak U et al. Loss of the ClC-7 Chloride Channel Leads to Osteopetrosis in Mice and Man. Cell 2001;104(2):205–15. doi: 10.1016/S0092-8674(01)00206-9.
7. Guo J, Bervoets TJM, Henriksen K, Everts V, Bronckers AL. Null mutation of chloride channel 7 (Clcn7) impairs dental root formation but does not affect enamel mineralization Cell Tissue Res. 2016;363(2):361–70. doi: 10.1007/s00441-015-2263-z.
8. Hammarstrom L, Blomlöf L, Lindskog S. Dynamics of dentoalveolar ankylosis and associated root resorption. Dent Traumatol. 1989;5(4):163–75. doi: 10.1111/j.1600-9657.1989.tb00354.x.
9. Cohen-Levy J. Ankylosis of permanent first molars: Genetics or environment? A case report of a discordant twin pair. International Orthodontics 2011;9(1):76–91. doi: 10.1016/j.ortho.2010. 12. 007.
10. Dewhurst SN, Harris JC, Bedi R. Infraocclusion of primary molars in monozygotic twins: report of two cases. International Journal of Paediatric Dentistry 1997;7(1):25–30. doi: 10.1111/j.1365-263X.1997.tb00269.x.
11. Cozza P, Gatto R, Ballanti F, De Toffol L, Mucedero M. Case report: severe infraocclusion ankylosis occurring in siblings. Eur. J Paediatr Dent, 2004;5(3):174–78.
12. Andersson L. Dentoalveolar ankylosis and associated root resorption in replanted teeth. Experimental and clinical studies in monkeys and man. Swed Dent J Suppl, 1988;56:1–75.
13. da Silva AC, Passeri LA, Mazzonetto R, de Moraes M, Moreira RW. Incidence of dental trauma associated with facial trauma in Brazil: a 1-year evaluation. Dent. Traumatol. 2004;20(1):6–11. doi: 10.1111/j.1600-4469.2004.00212.x.
14. Lauridsen E, Andreasen JO, Bouaziz O, Andersson L. Risk of ankylosis of 400 avulsed and replanted human teeth in relation to length of dry storage: A re-evaluation of a long-term clinical study. Dent. Traumatol. 2020;36(2):108–16. doi: 10.1111/edt.12520.
15. Campbell KM, Casas MJ, Kenny DL. Ankylosis of traumatized permanent incisors: pathogenesis and current approaches to diagnosis and management. J. Can. Dent. Assoc. 2005;71(10):763–68.
16. Aslan H, Marius C, Shemesh A, Weber M, Birnboim-Blau G. Ankylosed permanent teeth: incidence, etiology and guidelines for clinical management. Med. Dent. Res. 2018;1(1):1-11. doi: 10.15761/MDR.1000101.
17. Andreasen JO. Periodontal healing after replantation of traumatically avulsed human teeth: Assessment by mobility testing and radiography. Acta Odontologica Scandinavica 1975;33(6):325–35. doi: 10.3109/00016357509004637.
18. Andreasen JO. Effect of extra-alveolar period and storage media upon periodontal and pulpal healing after replantation of mature permanent incisors in monkeys. Int. J.Oral Surg. 1981;10(1):43–53. doi: 10.1016/S0300-9785(81)80007-5.
19. Lindskog S, Pierce AM, Blomlof L, Hammarstrom L. The role of the necrotic periodontal membrane in cementum resorption and ankylosis. Dent. Traumatol. 1985;1(3):96–101. doi: 10.1111/j.1600-9657.1985.tb00569.x.
20. Keum K, et al. Effect of Dexamethasone on Root Resorption After Delayed Replantation of Rat Tooth. J. Endodontics 2003;29(12):810–13. doi: 10.1097/00004770-200312000-00006.
21. Lustosa-Pereira A, Garcia RB, de Moraes IG, Bernardineli N, Bramante CM, Bortoluzzi EA. Evaluation of the topical effect of alendronate on the root surface of extracted and replanted teeth. Microscopic analysis on rats’ teeth. Dent Traumatol. 2006;22(1):30–5. doi: 10.1111/j.1600-9657.2006.00417.x.
22. Filippi A, Pohl Y, von Arx T. Treatment of replacement resorption by intentional replantation, resection of the ankylosed sites, and Emdogain-results of a 6-year survey. Dent. Traumatol. 2006;22(6):307–11. doi: 10.1111/j.1600-9657.2005.00363.x.
23. Kim SG, Ryu SI. Enamel matrix derivative for replanted teeth in animal models: a systematic review and metaanalysis. Restor. Dent. Endod. 2013;38(4):194. doi: 10.5395/rde.2013. 38. 4.194.
24. Oka K. Fibrillin protein, a candidate for creating a suitable scaffold in PDL regeneration while avoiding ankylosis. Genesis 2022;60(8–9): e23486. doi: 10.1002/dvg.23486.
25. Tronstad L. Root resorption - etiology, terminology and clinical manifestations. Dent. Traumatol. 1988;4(6):241–52. doi: 10.1111/j.1600-9657.1988.tb00642.x.
26. Zhang M. et al. Induced ankylosis of primary canines for absolute anchorage in the treatment of a patient with Class III malocclusion and cleft soft palate. Amer. J. Orthodont. dentofacial Orthoped. 2019;155(3):398–410. doi: 10.1016/j.ajodo.2017. 08. 031.
27. Becker A, Abramovitz I, Chaushu S. Failure of treatment of impacted canines associated with invasive cervical root resorption. Angle Orthodont. 2013;83(5):870–6. doi: 10.2319/090812-716. 1.
28. Marek I, Podškubková A, Novosad M. Interdisciplinární spolupráce u složitých kazuistik / 4. díl: Generalizovaná ankylóza zubů jako komplikace ortodontické terapie a její protetické řešení. LKS 2016;26(6):142–51.
29. Angelopoulou MV, Koletsi D, Vadiakas G, Halazonetis DJ. Induced ankylosis of a primary molar for skeletal anchorage in the mandible as alternative to mini-implants. Prog. Orthodont. 2015;16(1):18. doi: 10.1186/s40510-015-0090-0.
30. Ideno H, Komatsu K, Nakashima K, Nifuji A. Tooth transplantation and replantation: Biological insights towards therapeutic improvements. Genesis 2022;60(8–9): e23496. doi: 10.1002/dvg.23496.
31. Becktor KB et al. Unilateral primary or secondary retention of permanent teeth, and dental malformations’ Eur. J. Orthodont. 2002;24(2):205–14. doi: 10.1093/ejo/24. 2. 205.
32. Loriato LB, Machado AW, Souki BQ, Pereira TJ. Late diagnosis of dentoalveolar ankylosis: Impact on effectiveness and efficiency of orthodontic treatment. Amer. J. Orthodont. dentofacial Orthop. 2009;135(6):799–808. doi: 10.1016/j.ajodo.2007. 04. 040.
33. Mullally BH, Blakely D, Burden DJ. Ankylosis: an orthodontic problem with a restorative solution. Brit. dent J. 1995;179(11):426–29. doi: 10.1038/sj.bdj.4808947.
34. Messer LB, Cline JT. Ankylosed primary molars: results and treatment recommendations from an eight-year longitudinal study. Pediatr. Dent. 1980;2(1):37–47.
35. Ducommun F, Bornstein MM, Bosshardt D, Katsaros C, Dula K. Diagnosis of tooth ankylosis using panoramic views, cone beam computed tomography, and histological data: a retrospective observational case series study. Eur. J. Orthodont. 2018;40(3):231–8. doi: 10.1093/ejo/cjx063.
36. Paris M, Trunde F, Bossard D, J. Farges JC, and J. L. Coudert JL. L’ankylose dentaire : diagnostic par tomodensitométrie et reconstruction tridimensionnelle. Journal de Radiologie 2010;91(6):707–11. doi: 10.1016/S0221-0363(10)70101-3.
37. Bertl MH, Weinberger T, Schwarz K, Gruber R, Crismani AG. Resonance frequency analysis: a new diagnostic tool for dental ankylosis: RFA diagnostics for dental ankylosis. Eur. J. Oral Sci. 2012;120(3):255–8. doi: 10.1111/j.1600-0722.2012.00959.x.
38. Rhoads SG, Hendricks HM, Frazier-Bowers SA. Establishing the diagnostic criteria for eruption disorders based on genetic and clinical data. Amer.J. Orthodont. dentofacial Orthop. 2013;144(2):194–202. doi: 10.1016/j.ajodo.2013. 03. 015.
39. Frazier-Bowers SA, Simmons D, Wright JT, Proffit WR, Ackerman JL. Primary failure of eruption and PTH1R: The importance of a genetic diagnosis for orthodontic treatment planning Amer.J. Orthodont. dentofacial Orthop. 2010;137(2):p. 160.e1-160.e7. doi: 10.1016/j.ajodo.2009. 10. 019.
40. Phelan MK, Moss RB, Powell RS, Womble BA. Orthodontic management of ankylosed teeth. J. Clin. Orthodont. 1990;24(6):375–8.
41. Černochová P. Ankylóza zubů. Čes. Stomat. 2005;105(2):52–6.
42. Medeiros PJ, Bezerra AR. Treatment of an ankylosed central incisor by single-tooth dento-osseous osteotomy. Amer.J. Orthodont. dentofacial Orthop. 1997;112(5):496–501. doi: 10.1016/S0889-5406(97)70076-3.
43. Ohkubo K et al. Treatment of ankylosed maxillary central incisors by single-tooth dento-osseous osteotomy and alveolar bone distraction. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology 2011;111(5):561–67. doi: 10.1016/j.tripleo.2010. 06. 026.
44. Starosta M, Marek I. Osteodistrakce při řešení ankylóz. LKS 2014;24(1):8–13.
45. Chu EY et al. Genetic and pharmacologic modulation of cementogenesis via pyrophosphate regulators. Bone 2020;136:p. 115329. doi: 10.1016/j.bone.2020.115329.
46. Hessle L et al. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U.S.A. 2002;99(14):9445–9. doi: 10.1073/pnas.142063399.
47. Ao M et al. Overlapping functions of bone sialoprotein and pyrophosphate regulators in directing cementogenesis. Bone 2017;105:pp.134–47. doi: 10.1016/j.bone.2017. 08. 027.
48. Bobryshev Y, Orekhov A, Sobenin I, Chistiakov D. Role of Bone-Type Tissue-Nonspecific Alkaline Phosphatase and PHOSPO1 in Vascular Calcification. CPD 2014;20(37):5821–8. doi: 10.2174/1381612820666140212193011.
49. Briolay A, Bessueille L, Magne D. TNAP: A New Multitask Enzyme in Energy Metabolism. IJMS 2021;22(19):10470. doi: 10.3390/ijms221910470.
50. Minashima T, Quirno M, Lee YJ, Kirsch T. The role of the progressive ankylosis protein (ANK) in adipogenic/osteogenic fate decision of precursor cells. Bone 2017;98:38–46. doi: 10.1016/j.bone.2017. 03. 003.
51. Ho AM, Johnson MD, Kingsley DM. Role of the mouse ank gene in control of tissue calcification and arthritis. Science 2000;289(5477):265–70. doi: 10.1126/science.289.5477.265.
52. Kim HJ, Minashima T, McCarthy EF, Winkles JA, Kirsch T. Progressive ankylosis protein (ANK) in osteoblasts and osteoclasts controls bone formation and bone remodeling. J. Bone Miner. Res. 2010;25(8):1771–83. doi: 10.1002/jbmr.60.
53. Gurley KA, Reimer RJ, Kingsley DM. Biochemical and genetic analysis of ANK in arthritis and bone disease, Amer. J. Hum. Genet. 2006;79(6):1017–29. doi: 10.1086/509881.
54. Kato K et al. Crystal structure of Enpp1, an extracellular glycoprotein involved in bone mineralization and insulin signaling. Proc. Natl. Acad. Sci. U.S.A. 2012;109(42):16876–81. doi: 10.1073/pnas.1208017109.
55. Okawa A, Nakamura I, Goto S, Moriya H, Nakamura Y, Ikegawa S. Mutation in Npps in a mouse model of ossification of the posterior longitudinal ligament of the spine. Nat. Genet. 1998;19(3):271–73. doi: 10.1038/956.
56. Chu EY et al. Genetic and pharmacologic modulation of cementogenesis via pyrophosphate regulators. Bone 2020;136:115329. doi: 10.1016/j.bone.2020.115329.
57. Harmey D, Hessle L, Narisawa S, Johnson KA, Terkeltaub R, Millán JL. Concerted regulation of inorganic pyrophosphate and osteopontin by akp2, enpp1, and ank: an integrated model of the pathogenesis of mineralization disorders. Amer. J. Pathol. 2004; 164(4):1199–209. doi: 10.1016/S0002-9440(10)63208-7.
58. Zweifler LE et al. Counter-regulatory phosphatases TNAP and NPP1 temporally regulate tooth root cementogenesis. Int. J. Oral Sci. 2015;7(1):27–41. doi: 10.1038/ijos.2014. 62.
59. Foster BL et al. Central role of pyrophosphate in acellular cementum formation. PLoS One 2012;7(6):p. e38393. doi: 10.1371/journal.pone.0038393.
60. Bowden SA, Foster BL. Profile of asfotase alfa in the treatment of hypophosphatasia: design, development, and place in therapy. DDDT 2018;12:3147–61. doi: 10.2147/DDDT.S154922.
61. Beertsen W, VandenBos T, Everts V. Root development in mice lacking functional tissue non-specific alkaline phosphatase gene: inhibition of acellular cementum formation. J. Dent. Res. 1999;78(6):1221–9. doi: 10.1177/00220345990780060501.
62. Foster BL et al. Tooth root dentin mineralization defects in a mouse model of hypophosphatasia. J. Bone Miner. Res. 2013;28(2):271–82. doi: 10.1002/jbmr.1767.
63. Foster BL et al. Tooth root dentin mineralization defects in a mouse model of hypophosphatasia J. Bone Miner. Res. 2013;28(2):271–82. doi: 10.1002/jbmr.1767.
64. Yadav MC et al. Enzyme replacement prevents enamel defects in hypophosphatasia mice. J. Bone Miner. Res. 2012;27(8):1722–34. doi: 10.1002/jbmr.1619.
65. Ao M et al. Overlapping functions of bone sialoprotein and pyrophosphate regulators in directing cementogenesis. Bone 2017;105:134–47. doi: 10.1016/j.bone.2017. 08. 027.
66. Thumbigere-Math V et al. Hypercementosis Associated with ENPP1 Mutations and GACI. J. Dent. Res. 2018;97(4):432–41. doi: 10.1177/0022034517744773.
67. Chen L-P, Tadinada A, Dutra EH, Utreja A, Uribe F, Reichenberger EJ. Dental Anomalies Associated with Craniometaphyseal Dysplasia. J. Dent. Res. 2014;93(6):553–8. doi: 10.1177/0022034514529304.
68. Takano Y et al. Possible role of dentin matrix in region-specific deposition of cellular and acellular extrinsic fibre cementum. J. Electron Microsc. (Tokyo) 2003;52(6):573–80. doi: 10.1093/jmicro/52. 6. 573.
69. Alatli I, Hammarström L. Root surface defects in rat molar induced by 1-hydroxyethylidene-1,1-bisphosphonate Acta Odontol. Scand. 1996;54(1):59–65. doi: 10.3109/00016359609003511.
70. Alatli-Kut I, Hultenby K, Hammarström L. Disturbances of cementum formation induced by single injection of 1-hydroxyethylidene-1,1-bisphosphonate (HEBP) in rats: light and scanning electron microscopic studies. Scand. J. Dent. Res. 1994;102(5):260–8. doi: 10.1111/j.1600-0722.1994.tb01466.x.
71. Beertsen W, Niehof A, Everts V. Effects of 1-hydroxyethylidene-1, 1-bisphosphonate (HEBP) on the formation of dentin and the periodontal attachment apparatus in the mouse. Amer. J. Anat. 1985;174(1):83–103. doi: 10.1002/aja.1001740107.
72. Foster BL et al. The Progressive Ankylosis Protein Regulates Cementum Apposition and Extracellular Matrix Composition. Cells Tissues Organs 2011;194(5):382–405. doi: 10.1159/000323457.
73. Nociti FH et al. Cementum: a phosphate-sensitive
Korespondující autor:
MUDr. et MUDr. Jan Štembírek, Ph.D.
Klinika ústní, čelistní a obličejové chirurgie
FN a LF Ostravské university
Opavská 787, 708 00 Ostrava-Poruba